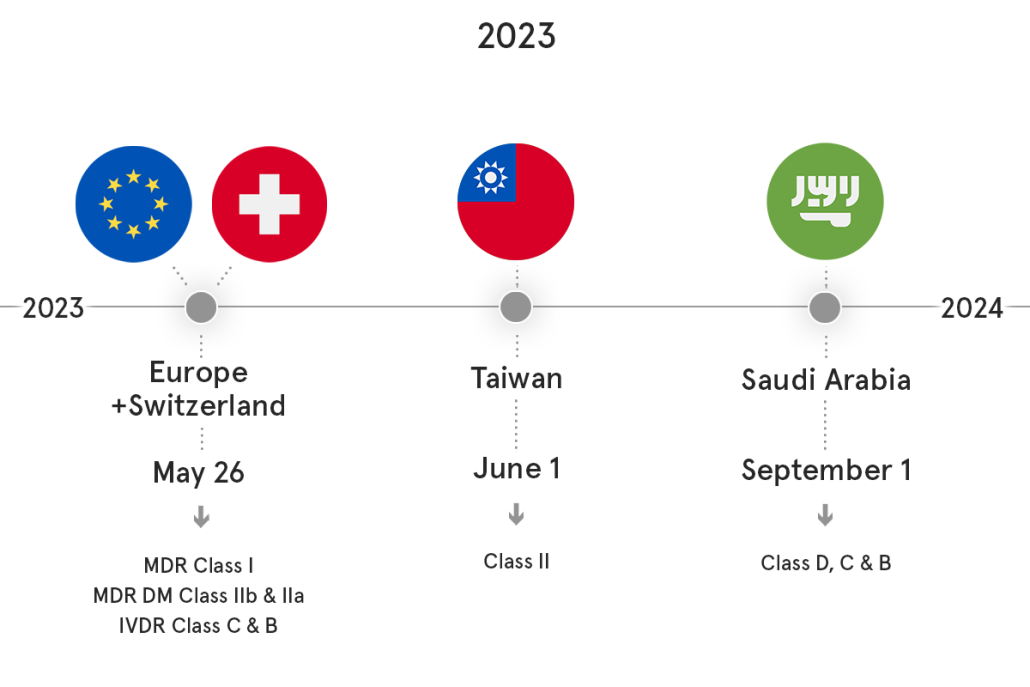
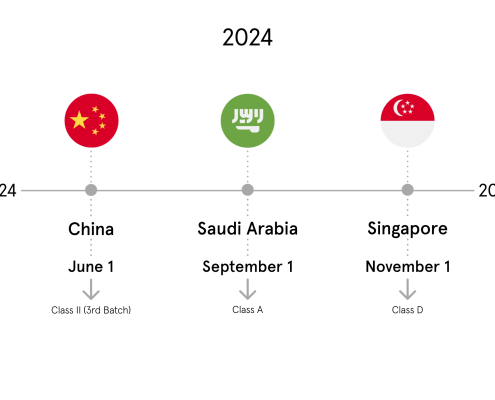
Haftungsausschluss
p36 übernimmt keine Haftung oder Verantwortung für Schäden oder Folgeschäden jeglicher Art, die aus der Nutzung der bereitgestellten Informationen entstehen.
Alle Informationen, Erklärungen und Angaben sind unverbindlich und können von p36 jederzeit ohne vorherige Ankündigung ganz oder teilweise geändert oder gelöscht werden.
Alle Angaben beziehen sich auf den aktuellen Kenntnisstand von p36 zum Zeitpunkt der Veröffentlichung. Wir bemühen uns, alle zur Verfügung gestellten Informationen sorgfältig auszuwählen und bei Bedarf zu aktualisieren, aber alle Informationen/zukunftsgerichteten Aussagen unterliegen verschiedenen Risiken und Unsicherheiten, die dazu führen können, dass die tatsächlichen Ergebnisse wesentlich von den Erwartungen abweichen. Die Leser werden daher davor gewarnt, sich in unangemessener Weise auf solche Informationen/zukunftsgerichteten Aussagen zu verlassen.
Die Informationen dürfen nicht in einen Vertrag aufgenommen werden.
p36 übernimmt keine Gewähr oder Haftung für die Aktualität, Richtigkeit, Vollständigkeit oder Auslassung der veröffentlichten Informationen. Die Informationen stellen keine Zusage, kein Versprechen und keine rechtliche Verpflichtung dar. Alle Informationen stellen keine Beratung im Rechtssinne dar. p36 übernimmt keine Verantwortung für die Rechtswirksamkeit und rechtliche Zulässigkeit der Inhalte und Informationen. Die Informationen werden ohne jegliche Garantie, weder ausdrücklich noch stillschweigend, zur Verfügung gestellt.
Sie möchten als Erster von Änderungen der neuesten UDI-Anforderungen erfahren? Abonnieren Sie unseren Newsletter.
 https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt
https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt