Die Berichterstattung über Zeitpläne in der EU ist wie eine Achterbahnfahrt!
Aktuelle Top-Themen sind:
- Vorgeschlagene Verlängerung der Übergangsfristen für bestimmte IVDs:
- 12/2027 für Geräte mit hohem Risiko,
- 12/2028 für Geräte mittleren Risikos,
- 12/2029 für Geräte mit geringerem Risiko,
- Stufenweise Einführung von EUDAMED,
- Pflicht zur Benachrichtigung im Falle einer Unterbrechung der Lieferung (MDR & IVDR).
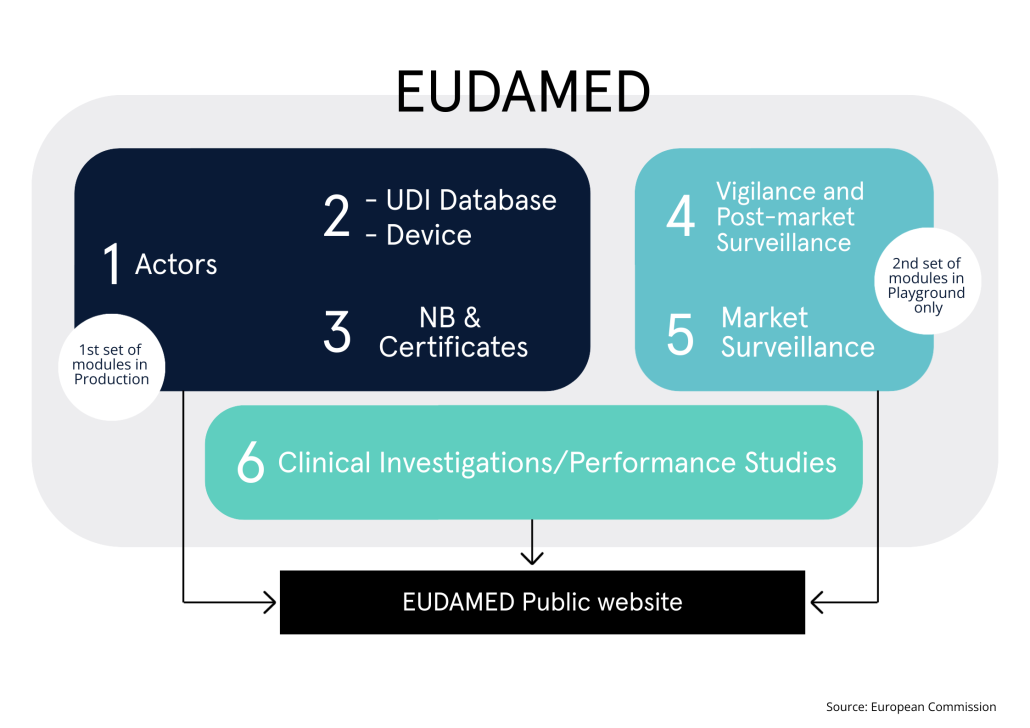
Da sie alle voneinander abhängig sind, wurden sie zu einem Änderungsvorschlag von MDR und IVDR zusammengefasst. Aus der Perspektive von UDI/EUDAMED sieht es so aus, als würden diejenigen, die nicht auf den letzten Aufruf gewartet haben, davon profitieren, indem sie die Aufwände der Hersteller reduzieren und die Belastung für lokale Behörden verringern und schließlich Informationen an die Öffentlichkeit liefern. Der aktualisierte Zeitplan, der jetzt vorgeschlagen wird, sieht eine Aufteilung der Veröffentlichung von EUDAMED in 3 Schritten vor:
- 1. Schritt (freiwillige Nutzung seit 10/2021):
- Akteure
- UDI-Datenbank/Geräte
- Benannte Stellen & Zertifikate
- 2. Schritt (freiwillige Nutzung ab ~07/2024):
- Vigilanz & Post-Market-Surveillance
- Marktüberwachung
- 3. Schritt (freiwillige Nutzung ab ~10/2026):
- Klinische Untersuchungen & Studien
Die Aktivierung einzelner EUDAMED-Module, sobald sie geprüft und als funktionsfähig erklärt wurden, könnte bedeuten: Es wird vorgeschlagen, dass die obligatorische Nutzung des 1. und 2. Satzes von Modulen im Januar 2026 beginnen könnte.
Wir empfehlen jedem, das Verfahren 2024/0021/COD in den kommenden Wochen genau zu beobachten!
Es muss noch geklärt werden, welche Teile von EUDAMED früher gestartet werden könnten und wie dies mit anderen Zeitplänen für die Anwendbarkeit von MDR/IVDR koordiniert wird.
 https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt
https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt