12. Mai 2022
Regulatory Update 04/2022
Liebe Leser:innen,
die Einhaltung der UDI-Vorschriften ist eine sehr schwierige Aufgabe, die jedoch notwendig ist, um sicherzustellen, dass Sie auf den aktuellen UDI-Märkten präsent bleiben, und die Ihnen die Möglichkeit gibt, sich auf kommende, unbekannte Vorschriften vorzubereiten.
Wie üblich möchten wir Ihnen mit unserem Newsletter einen Überblick über die aktuellen UDI-Anforderungen weltweit geben, um Sie bei den nächsten Schritten auf dem Weg zu Ihrer globalen UDI-Compliance zu unterstützen.
Darüber hinaus möchten wir Sie auf unseren Webcast zusammen mit SAP zum Thema “UDI Compliance can be Managed and Scaled” hinweisen.
Wir möchten Sie darauf hinweisen, dass die bereitgestellten Informationen von uns sehr sorgfältig ausgewählt worden sind. Dennoch können wir keine Garantie oder Haftung für die Aktualität, Richtigkeit, Vollständigkeit oder Auslassung der veröffentlichten Informationen übernehmen. Weitere Informationen finden Sie in unserem Haftungsausschluss.
Bleiben Sie gesund und zuversichtlich!
Mit freundlichen Grüßen,
Ihr p36-Team
Inhalt
UDI in Europa und Weltweit
- China I NMPA (CUDID)
- South Korea I MFDS (IMDIS)
- Saudi Arabia I SFDA (SAUDI-DI)
- Brazil I ANVISA
- Egypt I EDA
- Singapore I HSA (SMDR)
UDI in Europa und Weltweit
Immer mehr Aufsichtsbehörden bringen ihre eigenen UDI-Vorschriften auf den Weg – wie Brasilien, Singapur und Taiwan, um nur einige Märkte zu nennen.
Neben diesen bekannten und unbekannten Anforderungen wird es für Medizintechnikunternehmen immer wichtiger, eine globale Strategie für UDI und die Verwaltung der vielfältigen Daten weltweit zu entwickeln. Der folgende Abschnitt bietet daher einen kurzen Überblick über die, unserer Meinung nach, wichtigsten bevorstehenden weltweiten Änderungen für Sie als Hersteller von Medizinprodukten.
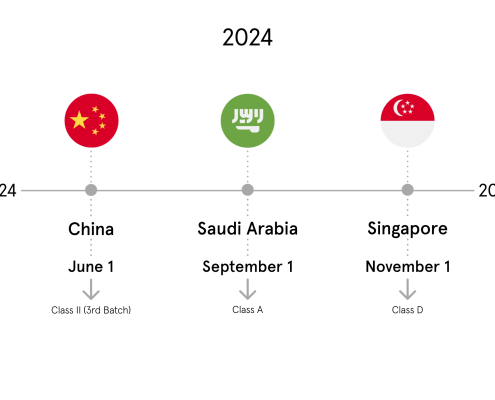
China I NMPA (CUDID)
Im September 2021 verkündete die NMPA die offizielle Frist für die Registrierung von Medizinprodukten in der chinesischen UDI-Datenbank CUDID, so dass die verbleibenden Medizinprodukte der Klasse III bis zum 1. Juni 2022 registriert sein müssen.
South Korea I MFDS (IMDIS)
Da die letzte Frist für Medizinprodukte der Klasse I in Südkorea am 1. Juli 2022 abläuft, empfiehlt es sich, die Produkte dieser Klasse für die Eintragung in die südkoreanische Datenbank IMDIS vorzubereiten.
Saudi Arabia I SFDA (SAUDI-DI)
Wie wir bereits in unserem letzten Newsletter informiert haben, wird die erste Frist für Medizinprodukte in Saudi-Arabien der 1. September 2022 sein. Produkte der Klassen D, C und B müssen bis zu diesem Datum registriert werden.
Brazil I ANVISA
Ende letzten Jahres veröffentlichte die ANVISA ihre offizielle Leitlinie zu den UDI-Anforderungen in Brasilien. Wie erwartet sind die UDI-Anforderungen an die Anforderungen der IMDRF angeglichen und gelten ab dem 10. Januar 2022.
Die Fristen für die Einhaltung der Vorschriften für Medizinprodukte sind je nach Risikoklasse wie folgt:
- Risikoklasse IV: 10. Juli 2024
- Risikoklasse III: 10. Januar 2025
- Risikoklasse II: 10. Januar 2026
- Risikoklasse I: 10. Januar 2028.
Egypt I EDA
Die ägyptische Regulierungsbehörde EDA hat kürzlich einen eigenen Leitfaden für ihre UDI-Anforderungen für Medizinprodukte veröffentlicht. Obwohl noch keine genauen Fristen bekannt sind, scheinen sich die Anforderungen, die für UDI in Ägypten erfüllt werden müssen, an den IMDRF-Leitlinien mit lokalen Anpassungen zu orientieren.
Sobald wir mehr Informationen zu den Fristen und der Umsetzung haben, werden wir Sie kurzfristig auf unseren Social Media Kanälen informieren.
Singapore I HSA (SMDR)
Letztes Jahr veröffentlichte Singapur seinen endgültigen Leitfaden zu den UDI-Anforderungen für Medizinprodukte.
Phase 1 wird am 1. November 2022 mit implantierbaren Medizinprodukten mit hohem Risiko beginnen, wie z. B. Koronarstents, orthopädische Gelenkersatzimplantate und Intraokularlinsen.
Webcast: UDI can be Managed and Scaled
Profitieren Sie von einer ganzheitlichen Strategie zur Erreichung der UDI-Compliance
Erfahren Sie, wie Prozessautomatisierung dazu beitragen kann, die globale UDI-Compliance sicherzustellen.
Eine der größten Herausforderungen für die Life Sciences-Branche sind die sich verändernden gesetzlichen Anforderungen. Und die Einhaltung der UDI-Vorschriften wird immer komplexer. Daher ist es jetzt an der Zeit, den Prozess der Stammdatenverwaltung und der Einreichung von Vorschriften zu automatisieren.
Um hier mithalten zu können, ist es entscheidend, eine unternehmensweite und globale Strategie für die zentrale Verwaltung von UDI-Produktdaten mithilfe von Prozessautomatisierung zu entwickeln, um die globale UDI-Compliance zu erreichen und sicherzustellen.
Doch wie können Sie die Einhaltung der Vorschriften gewährleisten und gleichzeitig neue Geschäftsmodelle einführen, die stärker auf den Patienten ausgerichtet und serviceorientiert sind?
Erfahren Sie als Erster von SAP und p36, wie Sie eine unternehmensweite und globale Strategie für die zentrale Verwaltung von UDI-Produktdaten mithilfe von Prozessautomatisierung entwickeln können, um die globale UDI-Compliance zu erreichen und zu gewährleisten.
Wir erörtern die Herausforderungen und Chancen der UDI-Compliance und wie Technologie dabei helfen kann:
- Die Komplexität der UDI-Compliance über viele Länder hinweg auf einer Plattform zu managen
- Effiziente Datenverwaltungsprozesse aufrechtzuerhalten
- Langfristige Sicherstellung der globalen UDI-Compliance
Wir hoffen, Sie finden diese Diskussion aufschlussreich!
Profitieren Sie von einer ganzheitlichen Strategie zur UDI-Compliance
Referenten
- Phil Foust, Global Partner Business Development, Life Sciences & Healthcare Ecosystems, SAP
- Patrick Pfau, Geschäftsführer, p36
Wir hoffen, dass dieser Newsletter Ihnen einen hilfreichen Überblick über die aktuellen UDI-Anforderungen in der ganzen Welt gegeben hat. Bitte denken Sie daran, dass sich die Zeitpläne ändern können.
Falls es Aktualisierungen gibt, werden wir Sie kurzfristig auf unseren Social Media Kanälen darüber informieren.
Haben Sie Fragen oder Anregungen zu unserem Newsletter?
Wir freuen uns, von Ihnen zu hören.
Haftungsausschluss
p36 übernimmt keine Haftung oder Verantwortung für Schäden oder Folgeschäden jeglicher Art, die aus der Nutzung der bereitgestellten Informationen entstehen.
Alle Informationen, Erklärungen und Angaben sind unverbindlich und können von p36 jederzeit ohne vorherige Ankündigung ganz oder teilweise geändert oder gelöscht werden.
Alle Angaben beziehen sich auf den aktuellen Kenntnisstand von p36 zum Zeitpunkt der Veröffentlichung. Wir bemühen uns, alle zur Verfügung gestellten Informationen sorgfältig auszuwählen und bei Bedarf zu aktualisieren, aber alle Informationen/zukunftsgerichteten Aussagen unterliegen verschiedenen Risiken und Unsicherheiten, die dazu führen können, dass die tatsächlichen Ergebnisse wesentlich von den Erwartungen abweichen. Die Leser werden daher davor gewarnt, sich in unangemessener Weise auf solche Informationen/zukunftsgerichteten Aussagen zu verlassen.
Die Informationen dürfen nicht in einen Vertrag aufgenommen werden.
p36 übernimmt keine Gewähr oder Haftung für die Aktualität, Richtigkeit, Vollständigkeit oder Auslassung der veröffentlichten Informationen. Die Informationen stellen keine Zusage, kein Versprechen und keine rechtliche Verpflichtung dar. Alle Informationen stellen keine Beratung im Rechtssinne dar. p36 übernimmt keine Verantwortung für die Rechtswirksamkeit und rechtliche Zulässigkeit der Inhalte und Informationen. Die Informationen werden ohne jegliche Garantie, weder ausdrücklich noch stillschweigend, zur Verfügung gestellt.
Sie möchten als Erster von Änderungen der neuesten UDI-Anforderungen erfahren? Abonnieren Sie unseren Newsletter.