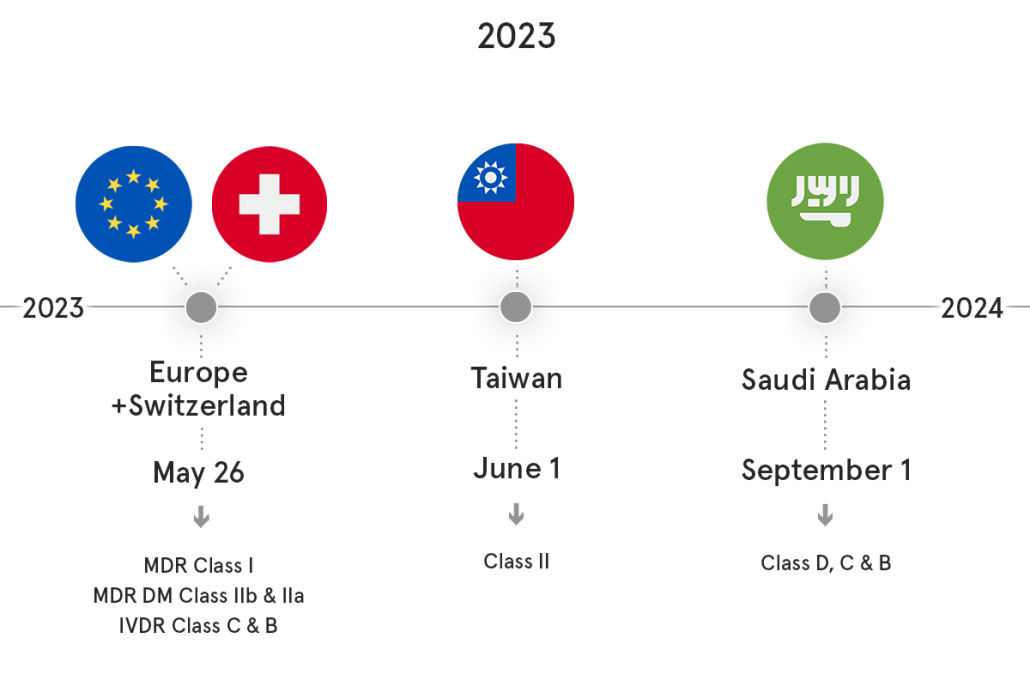
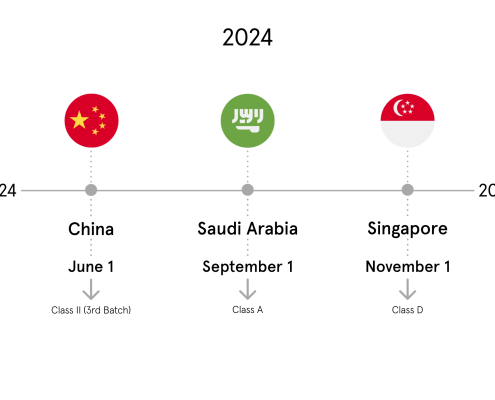
Derzeit sieht die australische TGA unter allen UDI-Regulierungsbehörden am robustesten und am meisten beschäftigt aus, und wir erwarten einen echten Durchbruch bei der Umsetzung von AusUDID!
Die freiwillige Compliance soll voraussichtlich ab Q2 2024 eröffnet werden!
Derzeit ist die Vorproduktionsumgebung für alle interessierten Parteien zur Registrierung und Prüfung geöffnet. Das Datenverzeichnis wird bald öffentlich zugänglich sein. Das Wichtigste ist, dass die TGA plant, AusUDID als ein wirklich vollständiges System mit verschiedenen Dateneinreichungsschnittstellen zu starten, um den Bedürfnissen der Branche gerecht zu werden. Offiziell wird es möglich sein, die manuelle Einreichungsschnittstelle für ein einzelnes Gerät und sowohl den Massen-Upload als auch die direkte M2M-Datenübertragung für mehrere Geräte gleichzeitig abwechselnd zu verwenden.
Außerdem können wir in diesem Jahr erwarten, dass die TGA die Fristen offiziell verlängert, um den Herstellern Zeit zu geben, vor dem Ende des Übergangs zum EU-MDR am 31. Dezember 2028 ein EU-MDR-Zertifikat zu erhalten, und für Sponsoren, das MDR-Zertifikat vor dem 1. Juli 2029 bei der TGA zu beantragen.
Derzeit gibt es keine Änderung im UDI-Umsetzungszeitplan auf den Geräten selbst, aber alle UDI-Themen werden diskutiert.
Es ist bestätigt, dass wir bis Ende dieses Jahres relevante Vorschriften zu all diesen Themen erwarten können.
 https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt
https://www.p36.io/wp-content/uploads/2024/03/atrify_Partnership_2024.jpg
1254
2400
Jennifer Meister
https://www.p36.io/wp-content/uploads/2023/03/p36_logo-1.png
Jennifer Meister2024-03-27 15:30:502024-03-27 15:44:04p36 GmbH und atrify GmbH, ein 1WorldSync Unternehmen, geben Partnerschaft zur globalen UDI-Compliance bekannt